023-67630383
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782热线/微信:13681365274
 销售咨询QQ2548969917
销售咨询QQ2548969917 技术咨询QQ1291769782
技术咨询QQ1291769782微信扫一扫
下载说明书


摘要:
背景:慢病毒载体能在分裂和非分裂细胞中实现稳定基因转移的有效载体。为提高生物安全性和转基因表达,现已对载体设计进行了多项改进,使这些载体被批准用于临床研究。因此,研究分析慢病毒载体生产质量、基因转移效率和治疗性基因表达程度的方法十分必要。
结果:我们比较了测量pg p24/ml、RNA含量/ml、转导单位(TU/ml)或mRNA含量的慢病毒载体滴定法。载体颗粒中基因组RNA的量被证明可以可靠地评估编码非荧光蛋白的载体的生产质量。然而,由于基于瞬时转染的载体生产的高度可变性,浓缩载体的RNA和p24滴度在预测转导效率方面相当差。此外,我们证明转基因mRNA水平与TU密切相关,可用于非荧光转基因的功能滴定。
慢病毒载体滴定方法的比较
慢病毒载体最常用的滴定方法是在细胞培养中有限稀释后,通过ELISA测定p24抗原浓度(pg p24/ml)或通过FACS分析测定转导单位的数量(TU/ml)。p24浓度测量功能性和非功能性载体颗粒,而TU严格测量导致荧光报告蛋白表达的功能性载体颗粒。为了比较不同方法的线性、可重复性和可变性,CH-eGFP-WS慢病毒载体被连续稀释(12步1/2稀释)并在细胞培养中进行RNA提取、p24 ELISA和转导。所有滴定方法与初始稀释系列具有良好的相关性:RT-qPCR后RNA/ml的r2 = 0.99,FACS后TU/ml的r2 = 0.93,ELISA后p24/ml的r2 = 0.94(图2)。当在有限稀释后确定转导滴度时,仅使用MOI《1的稀释度,导致低百分比的转导细胞,以最小化多重整合的风险。滴定取决于覆盖细胞的总体积、特定载体稀释液的孵育时间以及所用的细胞类型。仅在一半体积中以相同的MOI延长孵育或递送将显著影响滴度。然而,使用标准化条件,这些方法可以很好地估计载体质量和滴度。作为对照,我们检查了通过FACS测量的载体稀释度和转导效率(TE,即转导细胞的百分比)之间的相关性。最浓缩的载体稀释导致几乎100%的转导,而最稀释的样品导致TEs接近零(图2中的*号),并从线性回归中忽略。因此,TE仅与9次稀释相关,r2 = 0.95。
此外,为了估计每次测试的变异性,我们计算了不同方法的变异系数(CV)。RNA/ml、TU/ml和pg p24/ml的平均变异系数分别为39%、78%和103%。总之,RNA和p24浓度以及功能滴度是评估载体滴度数量级的可靠参数。然而,如CV所示,样品之间的绝对数值不同。p24 ELISA获得了最高的CV。p24测量的其他缺点是受限制的线性范围(13–200 pg/ml)以及随之而来的所需浓缩载体样品的大量稀释,这会影响再现性。TU/ml的高CV可能是由于转导或基因组随机整合时细胞数量的变化,导致转基因表达水平的差异。
p24或载体RNA浓度标准化后的基因表达分析
为了评估载体优化(启动子选择、增强子元件插入),在转导前标准化载体制备是很重要的。在这种情况下,不能使用功能滴定方法,如有限稀释后的FACS分析,因为该滴度取决于特定的主链。在这里,我们比较了转导前使用p24和载体RNA浓度对CH-eGFP-WS载体进行标准化的情况。制备CH-eGFP-WS衍生的慢病毒载体的单独产物,并在单次测试中测定RNA当量和p24浓度,以最小化测定间的差异。3天后通过FACS测定eGFP阳性细胞的百分比(表3)。观察到两种技术的不同产品之间的差异很大,CV约为50%。这种可变性可能是三重瞬时转染程序引起的变异和技术本身变异的组合,三重瞬时转染程序导致不同生产的蛋白质表达和病毒基因组生产不同(见上文)。Logan及其同事【16】已经描述了p24值的高变化,他们甚至对平行产生的载体测量了67.4 ng/ml至583.7 ng/ml的p24值。此外,对于RNA和p24测量,产物的相对转导值不同,表明两个参数之间的相关性差,并反映了这些参数分别依赖于转移质粒和包装质粒的转染的事实。p24和RNA浓度均可用于比较载体性能,前提是通过单次运行分析和平行的载体生产将测试的内在可变性降至最低。总之,RNA滴度和p24值在预测基因转移效率方面都很差。尽管如此,它们仍可用于载体制剂的标准化。
评估用于评估慢病毒载体生产质量和动力学的滴定方法的可靠性
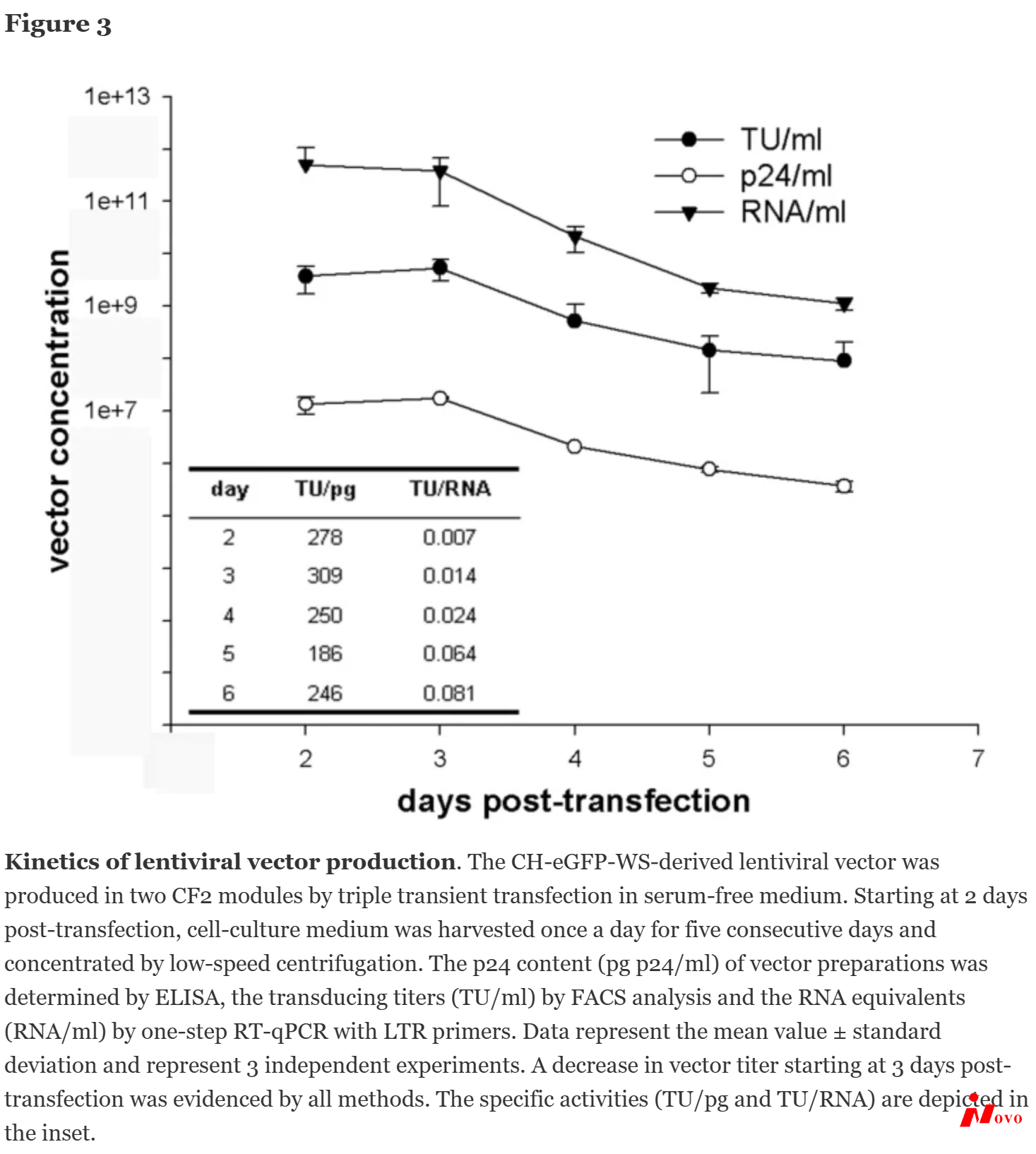
在我们的载体核心中,慢病毒载体每周产生一次。三重瞬时转染后2天和3天,在无血清培养基中常规收获含有慢病毒载体的细胞上清液【8】。为了更详细地分析慢病毒载体生产的动力学并研究长时间收获的可能性,如前所述【8】,在两个双层细胞工厂中生产CH-eGFP-WS衍生的载体。连续五天(转染后第2天至第6天)每天收获一次上清液,随后通过低速离心浓缩(5小时,26,000 g)。图3显示了生产期间不同参数的动力学。从第3天开始,载体滴度开始下降,三种滴定方法证明了这一点。尽管载体滴度下降,但在第4天和第5天仍产生大量高质量的载体。TU/RNA中的比活性在每个收获日都会增加,而TU/pg中的比活性每天都会显示可比值(图3)。这些结果表明,在以后的时间点,产生了具有最高比活性(TU/RNA)的载体。可以想象瞬时转染在生产的后期将不是最佳的,并且随着生产细胞的进一步分裂,表达将逐渐丧失,导致载体浓度(TU/ml、RNA/ml和pg p24/ml)下降10-100倍。此外,培养基更换时生产细胞的少量损失将进一步导致滴度的及时下降。基于这些结果和实际原因,我们决定在转染后第2天和第3天收获最先进的载体,因为大多数实验需要高滴度载体。
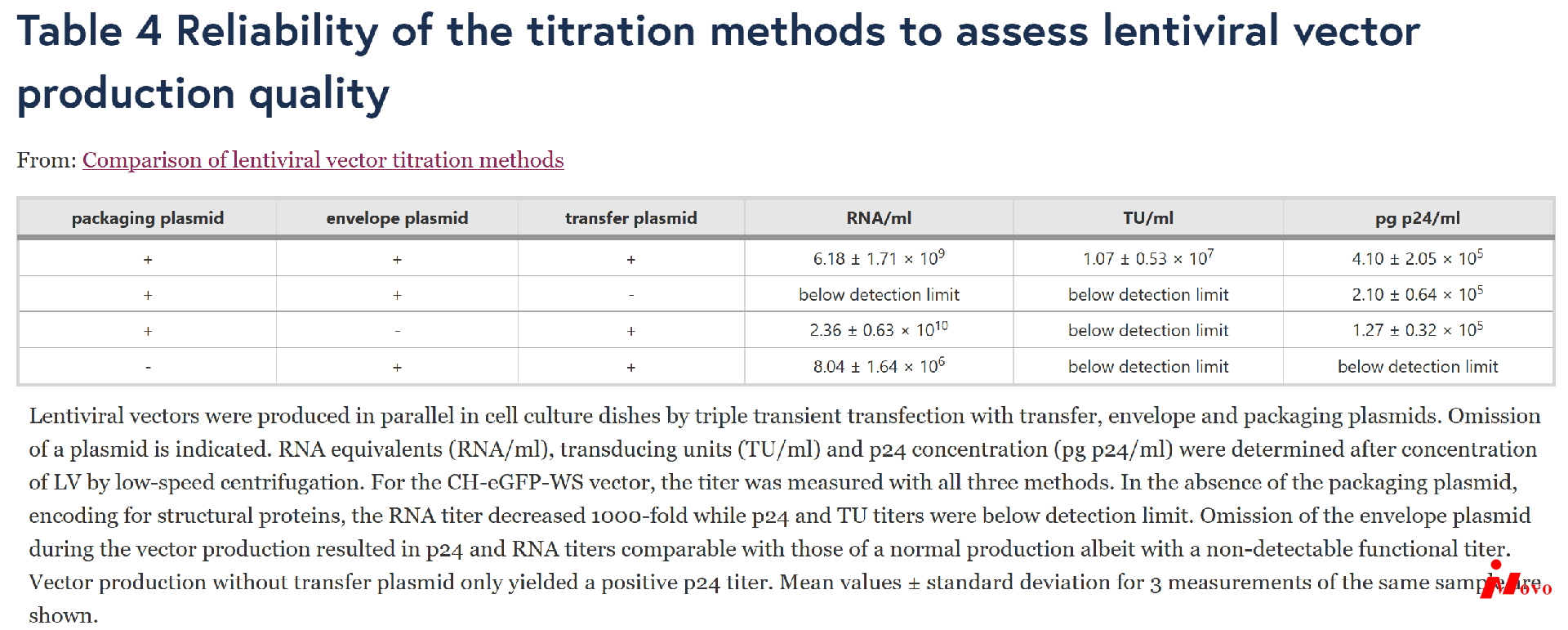
除了定量慢病毒载体浓度外,优化的RT-qPCR还为我们提供了一种替代方法来评估生产后的载体质量。事实上,大多数转移质粒编码非荧光转基因,因此p24浓度是唯一的质量控制。为了评估分析载体生产质量的不同滴定方法的可靠性,通过包膜、包装和转移质粒的三重瞬时转染在2层细胞工厂中生产CH-eGFP-WS载体。为了保持恒定的转染效率,在进行标准生产的同时,用对照质粒代替三种质粒中的任何一种进行了三次额外的生产。通过低速离心浓缩载体后测定滴度(pg p24/ml、RNA/ml和TU/ml)(表4)。尽管如功能滴度(TU/ml)所示,标准载体生产产生了全功能载体颗粒,但生产过程中任何其他质粒的缺失都没有产生可检测的功能滴度。正如预期的那样,在生产过程中省略转移质粒(编码病毒载体基因组)导致产生空的、无功能的载体颗粒,这反映在功能滴度(TU/ml)和RNA滴度的缺失上。令人惊讶的是,p24浓度与标准载体没有显著差异。事实上,仅仅包装质粒的存在就导致了所有生产方案中正常的p24值。在载体生产过程中排除编码VSV-G的包膜质粒导致p24和RNA滴度与正常载体生产相当,而功能滴度保持在检测限(TU/ml)以下,推断产生了细胞摄取缺陷的载体颗粒。此外,该结果表明,我们的慢病毒载体的转导没有被游离eGFP、DNA或RNA的假转导所扭曲。显然,包装质粒的省略导致p24抗原的缺失和无功能颗粒的产生(无TU/ml)。尽管获得的RNA滴度降低了三个对数级,但RNA转录物显然在有限程度上污染了载体制剂。这与Ikeda等人【24】的结果一致,他们也证明了在没有Gag-Pol的情况下,RNA分泌仅占包装RNA的0.1 %。此外,该结果证实了从表2中得出的结论,即主要是全长RNA转录物被整合到慢病毒载体构建体中。
我们的结果清楚地表明,p24浓度对于载体生产后功能性载体颗粒的评估是最不可靠的。然而,这是一种快速方法,可用于常规载体生产的质量控制。Logan及其同事【16】描述了如何控制转移、包装或包膜质粒的量不改变比活性(TU/pg p24),而是影响上清液中的载体浓度(TU/ml和pg p24/ml)。然而,如果编码非荧光转基因,则无法确定功能滴度,人们必须依靠RNA浓度来指示基因组RNA的存在。该RNA滴度如何与功能滴度相关取决于载体构建体(见表1)、转基因和启动子,并需要通过qPCR进一步分析整合的前病毒基因组或通过RT-qPCR、蛋白质印迹或转导后的免疫细胞化学进一步分析转基因表达水平。
RT-qPCR评价转基因表达
最终,基因转移载体的未来临床应用将需要精确测定任何治疗性转基因的表达水平。Lizee和同事【15】成功地应用了定量和通用的两步RT-qPCR方法(使用DNA标准品)来确定转导细胞中的mRNA表达水平,该方法使用位于WPRE的引物-探针组,存在于转基因mRNA的3’UTR。相比之下,我们优化了一步RT-qPCR,同样使用WPRE引物探针组,但使用RNA标准来量化表达水平(图1A)。为了评估再现性,在293T细胞上连续稀释(1/10)CH-eGFP-WS慢病毒载体。通过FACS和RT-qPCR测量转基因表达(eGFP)。为人类RNA酶P(看家基因)设计的引物探针组被添加到每个样品中,以使总RNA含量标准化。同样,RNA标准品(5 × 103至5 × 108 RNA当量/反应,斜率= -3.2)与样品和无扩增对照一起采集。随后,计算相对值并表示为每ng总RNA的RNA拷贝数(mRNAc/ng)。总转导效率通过将eGFP阳性细胞的百分比(TE)与平均荧光强度(MFI)相乘来计算。如图4所示,慢病毒载体转基因表达(通过FACS测量)和转基因RNA表达(通过RT-qPCR测量)强相关(相关系数r2 = 0.97),表明该方法可用于测量非荧光转基因表达。观察到MFI的差异,并与细胞中表达的eGFP的量有关,这可能取决于整合位点或整合拷贝数,并取决于内部启动子和细胞类型。mRNA表达水平的差异也取决于这些因素,如TE和mRNAc/ng之间的相关性所示(r2 = 0.7)。因此,这种方法是荧光基因FACS分析的一种替代方法,但不能区分多重整合。描述了几种用于整合型前病毒基因组的基于DNA的定量PCR,但已知它们将eGFP滴度高估了6-60倍【13,15,27】,因为并非所有整合型载体都有助于活性基因表达。因此,RNA转基因表达水平与实际蛋白质表达水平的相关性最好,可以取代非荧光转基因的FACS分析,尽管这种方法更费力且更昂贵。此外,据报道,通过改变转导过程的条件,如接种体体积、靶细胞的类型和数量以及载体暴露于靶细胞的时间长度,载体滴度(TU/ml)的差异超过50倍【17】。因此,精确滴定程序的标准化仍然至关重要。
结论:
在本文中,对常用的慢病毒载体滴定方法进行了评估,并可作为该领域新人的指南。对于基础研究和最终的临床试验而言,了解这些滴定方法固有的性能特征和可变性至关重要。
由于慢病毒载体生产的瞬时性质,分别通过ELISA、FACS分析和RT-qPCR证明了生产过程固有的p24、TU和RNA水平的变化。这些方法可用于测量载体滴度,尽管即使在同一次运行中绝对数也可能有所不同。Nor RNA或p24滴度可以预测功能滴度,因为功能滴度依赖于载体构建体和用于转导的细胞类型。TU/RNA和TU/pg比率反映了慢病毒载体构建体的特异性活性,并被证明与载体骨架密切相关。基于RNA或p24值的载体生产的正常化受到瞬时转染和滴定方法的可变性的阻碍,应予以考虑。此外,为了评估编码非荧光基因的慢病毒载体生产的质量,RNA滴度是最可靠的,因为p24滴度不受转移质粒缺失的影响。我们还证明了转基因mRNA水平的定量分析与通过FACS测量的eGFP荧光非常相关,因此可以用作滴定编码非荧光转基因的载体或确定转导细胞中转基因表达水平的替代方法。